සාමාන්ය පෙළ පන්තියේ රසායන විද්යා පෙළපොතේ මුල් පිටු අතරේ රැඳෙන පාඩමක් තමයි, ආවර්තිතා වගුව. දැනට ලෝකයේ සොයාගෙන ඇති සියලු ම රසායනික මූලද්රව්ය විස්තරාත්මක ව පිළියෙළ කිරීමයි, එයින් සිදු කරන්නේ. වමේ සිට දකුණට සහ ඉහළ සිට පහළට පරමාණුක ක්රමාංකය වැඩි වන පිළිවෙළට සකසා ඇති ආවර්තිතා වගුවේ පිළිවෙළ, සාමාන්යයෙන් පරමාණුක ස්කන්ධය වැඩි වන ලෙස සමපාත වන බව පැවසිය හැකි යි.
© Karl Tate
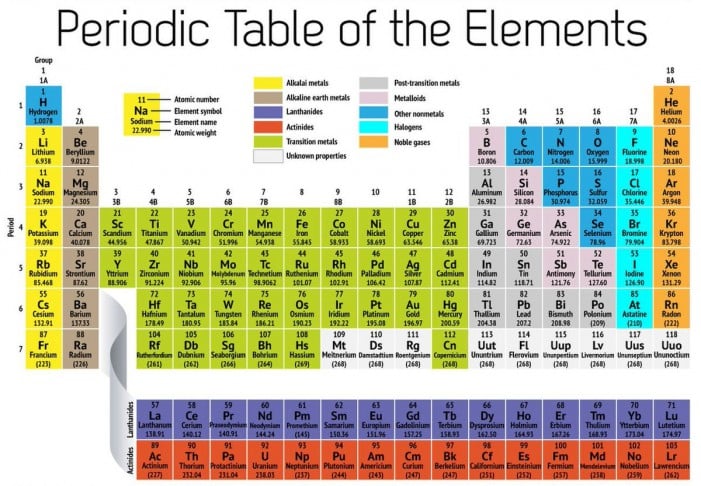
ආවර්තිතා වගුවේ ඇති තිරස් පේළි ‘ආවර්ත’ ලෙස හඳුන්වනවා. ආවර්ත අංකය මගින් පෙන්නුම් කරන්නේ යම් රසායනික මූලද්රව්යයක් සතු පරමාණුවල තිබෙන ඉලෙක්ට්රෝන පවතින කවච හෙවත් ප්රධාන ශක්ති මට්ටම් ගණන යි. ඒ අනුව ආවර්තිතා වගුවේ පහළට ගමන් කිරීමේ දී ආවර්තයක් සතු ශක්ති මට්ටම් සංඛ්යාව ක්රමයෙන් වැඩි වීම සිදු වෙනවා.
ආවර්තිතා වගුව සතු සිරස් තීරු හඳුන්වන්නේ ‘කාණ්ඩ’ ලෙස යි. රසායනික මූලද්රව්ය කාණ්ඩවලට වර්ගීකරණය කරන්නේ ඒවායේ අවසන් කවචයේ (ශක්ති මට්ටමේ) තිබෙන ඉලෙක්ට්රෝන සංඛ්යාව මත යි. එක ම කාණ්ඩයකට අයත් මූලද්රව්ය එක හා සමාන සංයුජතා වින්යාසයන් පෙන්නුම් කරන අතර සමාන හැසිරීම් රටාවන් ද පෙන්නුම් කරනවා.
ආවර්තිතා වගුවේ පියා
රසායන විද්යාව පිළිබඳ රාජකීය සංගමය, ආවර්තිතා වගුවේ පියා ලෙස සලකන්නේ රුසියානු ජාතික රසායන විද්යාඥයෙකු වූ දිමිත්රි මෙන්ඩලීව් ය. 1860 දශකයේ දී රුසියාවේ ශාන්ත පීටර්ස්බර්ග් සරසවියේ ජනප්රිය කථිකාචාර්යවරයෙකු ලෙස කටයුතු කළ ඔහු නූතන කාබනික රසායන විද්යාව හැදැරීම සඳහා නිසි පරිශීලන ග්රන්ථ නොමැති වීම නිසා ඒ සම්බන්ධයෙන් ග්රන්ථයක් ලිවීමට තීරණය කර තිබෙනවා. ග්රන්ථය සම්පාදනය කිරීම පහසුව සඳහා නිසි ලෙස මූලද්රව්ය පෙළ ගැස්සීමේ ප්රතිඵලයක් ලෙස ආවර්තිතා වගුව බිහි වන්නට ඇති බව සැලකෙනවා.

(© Wikimedia Commons) ආවර්තිතා වගුවේ පියා දිමිත්රි මෙන්ඩලීව්
මෙසේ මූලද්රව්ය නිසි පිළිවෙළට සැකසීම මුල් කාලයේ දී අතිශය බැරෑරුම් කටයුත්තක් වන්නට ඇති බවට සැකයක් නැහැ. අද සොයාගෙන ඇති මූලද්රව්ය අතරින් අඩක් ම එම යුගයේ දී අනාවරණය කරගෙන නොතිබුණු අතර බොහෝමයක් මූලද්රව්ය පිළිබඳ ව පැවති තොරතුරු ද අසත්ය ඒවා යි. ඒ හේතුවෙන් මුල් කාලයේ දී ආවර්තිතා වගුව ගොඩ නැංවීම කැබලි අඩු පින්තූර ප්රහේලිකාවක් සම්පූර්ණ කිරීමකට සමාන වූ බව පැවසීම වැරදි නැහැ.
කෙසේ හෝ අවසානයේ දී ඔහු බලාපොරොත්තු වූ පරිදි ම දිමිත්රි මෙන්ඩලීව් 1868 – 1870 අතර කාලයේ දී ‘රසායන විද්යා මූලධර්ම’ නමින් වෙළුම් ද්විත්වයකින් යුතු ග්රන්ථයක් එළි දැක්වීමට සමත් වුණා ඒ අනුව වර්තමාන ආවර්තිතා වගුවේ විකාශනය සඳහා විශාල වශයෙන් දායක වූ සොයා ගැනීමක් සිදු කරමින් ආවර්තිතා වගුවේ මුල් කාලීන ස්වරූපය, ඔහු විද්යා ලෝකයට හඳුන්වා දුන්නා.
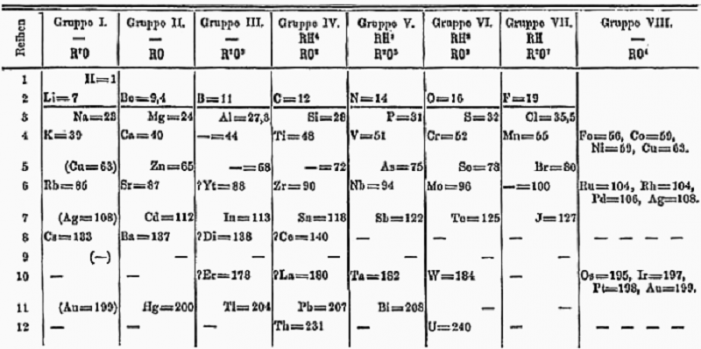
(© Wikimedia Commons) මෙන්ඩලීව්ගේ මුල් කාලීන ආවර්තිතා වගුව
තමන්ගේ ග්රන්ථය ප්රකාශයට පත් කිරීමෙන් පසුව ද දිගින් දිගටම ආවර්තිතා වගුව සම්බන්ධයෙන් කටයුතු කිරීමට දිමිත්රි මෙන්ඩලීව් තමන්ගේ කාලය ගත කළ අතර කපා ගන්නා ලද කාඩ්පත්වල අදාළ මූලද්රව්ය සහ ඒවායේ පරමාණුක ස්කන්ධය සටහන් කර ඒවා පරමාණුක ස්කන්ධය වැඩි වෙන පිළිවෙළට සකස් කිරීමට ඔහු කටයුතු කර තිබෙනවා. එහි දී ඔහුට දැක ගැනීමට ලැබුණේ ඇතැම් මූලද්රව්ය සඳහා සමාන ගති ලක්ෂණ පවතින බව යි. දිවා රෑ නොබලා මූලද්රව්ය කාඩ්පත් නිසි පිළිවෙළකට සකස් කිරීමට උත්සාහ කළ දිමිත්රි මෙන්ඩලීව්ට එම කාර්යය සාර්ථක ව අවසන් කර ගැනීමට හැකියාව ලැබී ඇත්තේ දින තුනකට පසු ව යි. ඇතැම් මූලාශ්ර සඳහන් කරන ආකාරයට ආවර්තිතා වගුව සම්පූර්ණ කළ යුතු ආකාරය ගැන ඔහු සිහිනයෙන් දැක තිබෙනවා.

(© Wikimedia Commons) දිමිත්රි මෙන්ඩලීව්ට ගෞරව පිණිස තනා ඇති ස්මාරකයක්
දිමිත්රි මෙන්ඩලීව් විසින් සැකසූ මුල් කාලීන ආවර්තිතා වගුවේ මූලද්රව්ය පිළිවෙළට සැකසීම සඳහා අදාළ මූලද්රව්යයේ පරමාණුක ස්කන්ධය මෙන් ම සංයුජතාවය ද සැලකිල්ලට ගෙන තිබෙන අතර ඒ කාලයේ සොයාගෙන නොතිබූ මූලද්රව්ය සඳහා ඔහු හිස්තැන් ඉතුරු කර තිබෙන බව පැවසෙනවා. තමන්ගේ නව සොයා ගැනීම සම්පූර්ණ කිරීමෙන් පසු ව ඔහු 1869 වර්ෂයේ දී එය රුසියානු රසායන විද්යා සංගමයට ඉදිරිපත් කළා. පසු ව ඔහුගේ ආවර්තිතා වගුව ජර්මානු රසායන විද්යා වාර සඟරාවක් වූ ‘Zeitschrift für Chemie’ හි ද පළ වී තිබෙනවා.
ආවර්තිතා වගුව කියවන අයුරු
ආවර්තිතා වගුව කියවීමේ දී අවධානය යොමු කළ යුතු වැදගත් කරුණු බොහෝමයක් පවතිනවා.
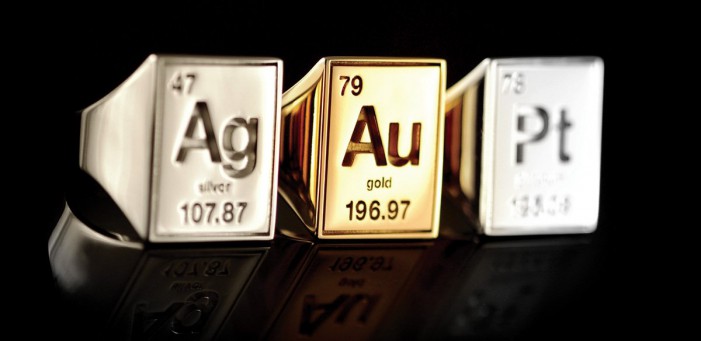
© Periodic & Diagrams Science
(1) පරමාණුක සංකේතය
පරමාණුක සංකේතය මගින් පෙන්නුම් කරන්නේ අදාළ මූලද්රව්ය නිරූපණය කිරීම සඳහා යොදා ගන්නා කෙටි යෙදුමක්. මෙය පෙන්නුම් කිරීම සඳහා ඉංග්රීසි අකුරක් හෝ අකුරු යොදා ගන්නවා. උදාහරණයක් ලෙස කාබන් හැඳින්වීම සඳහා C ද රන් පෙන්නුම් කිරීමට Au ද භාවිතා කරනවා.
(2) පරමාණුක ක්රමාංකය
පරමාණුක ක්රමාංකය ලෙස හැඳින්වෙන්නේ පරමාණුක අඩංගු වන ප්රෝටෝන ගණන යි. එය අදාළ මූලද්රව්ය හඳුනා ගැනීම සඳහා උපකාර වන අතර එහි රසායනික හැසිරීම ද තීරණය කරනවා. මෙය පරමාණුක සංකේතයේ වම්පස පහළ කෙළවරේ දැක ගැනීමට හැකි යි.
(3) ස්කන්ධ ක්රමාංකය
පරමාණුවක් තුළ තිබෙන උප පරමාණුක අංශු (එනම් ඉලෙක්ට්රෝන, ප්රෝටෝන සහ නියුට්රෝන) අතරින් ප්රෝටෝන සහ නියුට්රෝන ආසන්න වශයෙන් සමාන ස්කන්ධයකින් යුතු වෙනවා. කිසියම් මූලද්රව්ය පරමාණුවක න්යෂ්ටියේ අඩංගු ප්රෝටෝන සහ නියුට්රෝන සංඛ්යාවේ එකතුව හැඳින්වෙන්නේ ස්කන්ධ ක්රමාංකය ලෙස යි. මෙය දක්වා ඇත්තේ පරමාණුක සංකේතයේ වම්පස ඉහළ කෙළවරේ යි.
(4) පරමාණුක ස්කන්ධය
කිසියම් මූලද්රව්යයක සම්මත පරමාණුක ස්කන්ධය ලෙස සැලකෙන්නේ පරමාණුක ස්කන්ධ ඒකකවලින් දක්වන ලද අදාළ මූලද්රව්යයේ සාමාන්ය ස්කන්ධය යි.
කවරයේ පින්තූරය : Picture 6 (© Geek Insider)